El Ministerio de Salud de Costa Rica avaló, el viernes 24 de diciembre, la importación y el uso de autopruebas para la detección de COVID-19 como estrategia de tamizaje, según un comunicado de prensa emitido por esta cartera.
Quienes estén interesados en comercializar este tipo de pruebas tendrán que gestionar una autorización ante la Dirección de Atención al Cliente del Ministerio de Salud; cumpliendo con los requisitos y el procedimiento detallado en el lineamiento para la importación de las autopruebas, en tanto se concreta la aprobación de su registro sanitario.
Las autopruebas que pueden comercializarse y utilizarse en Costa Rica son aquellas que tienen un registro sanitario o una autorización temporal de ingreso del Ministerio de Salud y aplica solamente a las recomendadas por la Organización Mundial de la Salud (OMS), la Organización Panamericana de la Salud (OPS) o avaladas por las “autoridades reguladoras estrictas para la precalificación de pruebas in vitro”, especificó el Ministerio.
Adicionalmente, estas pruebas deben tener una sensibilidad igual o mayor a 80% y una especificidad igual o mayor a 95%; de acuerdo con lo establecido por Salud.
LEA MÁS: Ministerio de Salud da luz verde a la importación de autopruebas para detección de COVID-19
El trámite
De acuerdo con Nidia Morera, directora de la Dirección de Atención al Cliente del Ministerio de Salud, en los lineamientos generales para el uso de autopruebas de tamizaje para la COVID-19 se han establecido dos requisitos para la importación de estos productos.
En primer lugar, la persona física o jurídica debe contar con un permiso sanitario de funcionamiento vigente como importador de equipo y material biomédico, es decir, acorde al producto que pretende ingresar al territorio nacional.
El segundo requisito es que el interesado debe contar con una autorización del Ministerio de Salud para la importación del producto en particular, en este caso, las autopruebas de COVID-19.
Esta autorización puede obtenerse de dos maneras, según Morera.
Una de ellas es a través del registro sanitario -mecanismo de control que regularmente aplica Salud para los productos de interés sanitario-, el cual se gestiona mediante la plataforma digital llamada Regístrelo, y tiene una vigencia de cinco años.
En ella se deben aportar los requisitos establecidos para productos de clase 3 -categoría de este tipo de pruebas- en el Decreto N° 34482-S Reglamento para el Registro, Clasificación, Importación y Control de Equipo y Material Biomédico.
El artículo 8 de ese decreto indica que parte de los requisitos son llenar el formulario de solicitud de registro sanitario de equipo y material biomédico, y presentar el Certificado de Libre Venta y uso del país de origen, debidamente autenticado, legalizado por parte del consulado de Costa Rica en ese país acompañado de su traducción oficial, cuando el idioma de origen no sea el español.
LEA MÁS: ¿Cuándo se acaba una pandemia? Conozca las seis fases y el papel de las variantes
Por su parte, por un periodo de seis meses, a partir de la publicación del lineamiento, y considerando la situación epidemiológica actual de la pandemia en Costa Rica, “así como el énfasis dado a las medidas de responsabilidad personal y autocuidado, se ha resuelto permitir el ingreso y la comercialización de manera temporal de las autopruebas que cumplan con los requisitos y el procedimiento que se detallan (en el documento); lo anterior en tanto se concreta la aprobación de su registro sanitario”, dice el lineamiento.
Esto permitió que de manera temporal los interesados en importar estas pruebas tengan la opción de gestionar una autorización en la Dirección de Atención al Cliente del Ministerio de Salud, mientras les aprueban el registro sanitario.
La autorización puede tramitarse durante los siguientes seis meses y aplica para aquellas autopruebas que ya cuentan con el visto bueno de la OMS, la OPS o de una autoridad sanitaria estricta para este tipo de pruebas como Food and Drug Administration (FDA), Health Canada, etc.
En este caso, quienes deseen importar autopruebas de tamizaje para la COVID-19 deben enviar, al correo electrónico dac.ups.correspondencia@misalud.go.cr, una solicitud escrita detallando la descripción de la prueba, un certificado de las autoridades mencionadas o indicar el enlace oficial donde se puede confirmar la información, y las especificaciones técnicas y médicas del producto; explicó Morera.
Este trámite se resuelve en 10 días o “un poco menos”.
“El registro sanitario o la autorización de la Direccción de Atención al Cliente antes mencionados se presentan luego ante la Promotora de Comercio Exterior de Costa Rica (Procomer) y ante Aduanas para los trámites regulares que se realizan al momento de gestionar el desalmacenaje de la mercancía”, comentó la directora de la Dirección de Atención al Cliente del Ministerio de Salud.
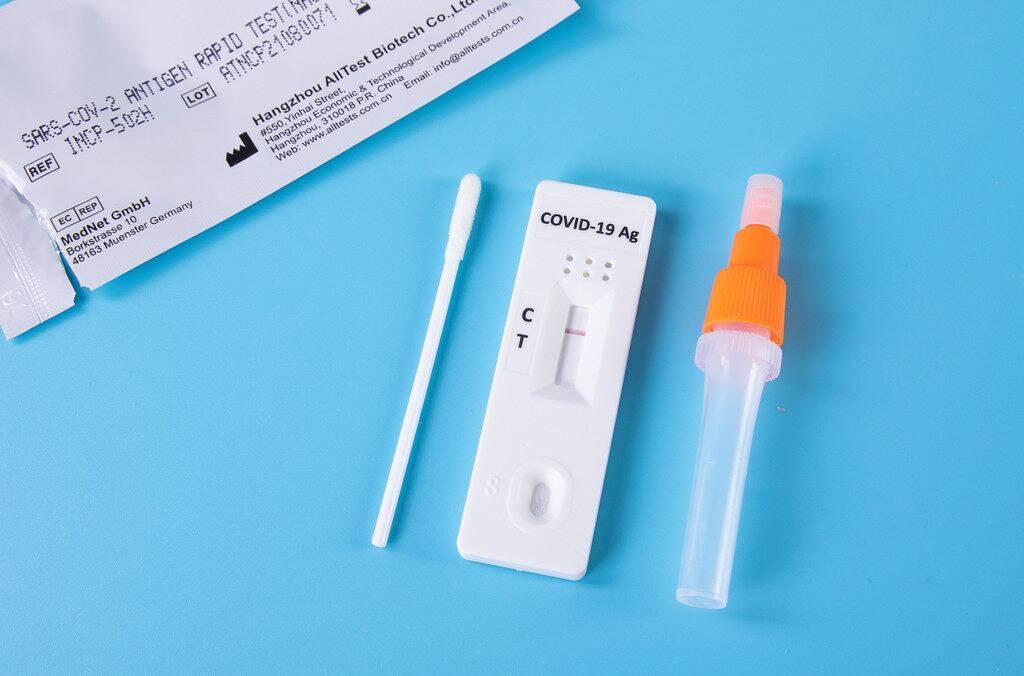
Autopruebas
Las autopruebas se pueden realizar en cualquier lugar, bajo responsabilidad personal, como medida para reducir el riesgo de transmisión de la COVID-19. Además, son fáciles de utilizar y generan resultados rápidamente.
El Ministerio de Salud instauró que las autopruebas que se comercialicen y se usen en el país deben tener una sensibilidad igual o mayor a 80% y una especificidad igual o mayor a 95%.
El término sensibilidad se refiere a la probabilidad de que el resultado de una prueba sea positivo si realmente tiene la enfermedad. Mientras que la especificidad es la probabilidad de que los resultados de una prueba sean negativos si realmente no tiene la enfermedad, explicó Salud en un comunicado de prensa.
Asimismo, el lineamiento del Ministerio especifica cuatro usos no autorizados de las autopruebas de tamizaje para COVID-19:
• Las pruebas no se autorizan como diagnóstico en ningún escenario, sino solo para autotamizaje.
• Las pruebas no se autorizan para hacer viajes a otros países, sino que debe respetarse lo solicitado por cada Estado en el extranjero.
• Las pruebas no se pueden utilizar como prueba en los centros de trabajo y otros para ausentarse, pues es necesaria una confirmación posterior para emitir la respectiva incapacidad u ordenamiento sanitario de aislamiento.
• Las pruebas no tienen validez legal ni diagnóstica, por lo que no pueden ser utilizadas como requisito de ningún tipo.
